Wnt 信号通路库
旨在发现新的 Wnt/β-catenin 信号通路有效调节剂
10 560 种化合物
Wnt/β-catenin 通路的失调通常是癌症和其他严重疾病的主要原因。Wnt 信号传导是一种高度保守的途径,控制着胚胎发育的所有步骤1-6和成熟生物体的组织维持8-11。阿尔茨海默氏症、多发性硬化症(MS)、多囊肾病(PKD)、2 型糖尿病、关节炎、结肠癌癌症、癌症和乳腺癌是 Wnt 通路功能障碍的一些例子。最近的证据表明,Wnt 通路的激活可以预防成骨17,30,31和神经退行性疾病18,32。
为了创建最好的 Wnt/β-catenin 信号调节剂库,我们专注于基本和临床相关的蛋白质靶点。我们使用了以下靶标的所有可用结构信息和活性数据:CK1α、GSK3α/β、卷曲(Fzd)受体和 Lrp 共受体(Lrp5/6)、锌和环指蛋白(Znrf3、Rnf43)、DKK1、Dvl-Axin、β-Catenin/TCF4、β-Catanin/Bcl9 和 Bcl9/PYGO/His3 相互作用抑制以及 Tankyrase 来组装文库。
潜在的 Wnt 信号调节剂库已经预装板,便于最方便、最快速的获取。使用我们的 Wnt 库,您可以获得多种好处,从而节省命中探索和后续优化的时间和成本:
- hit 确认支持:通过严格的质量控制从同一批次中搜索和命中样本重新供应
- 通过平行合成化学直接且经济地合成后续 hit 库
- 强化的医药化学支持与全面的 ADME/T 评估
典型格式
| 目录号 | 化合物数量 | 规格 | 储存形式 | 价格 |
| WPL-10-0-Z-10 | 10 560 9块板 |
≤300nL@10mM DMSO溶液 |
1536孔Echo LDV微孔板 前4列和后4列留空,每板1280个化合物 |
立即询价 |
| WPL-10-10-Y-10 | 10 560 33块板 |
10µL@10mM DMSO溶液 |
384孔LDV微孔板,Echo认证#001-12782 (LP-0200) 前2列和后2列分别留空,每板320个化合物 |
立即询价 |
| WPL-10-50-Y-10 | 10 560 33块板 |
50µL@10mM DMSO溶液 |
384孔板(Greiner Bio-One plates #781280) 前2列和后2列分别留空,每板320个化合物 |
立即询价 |
* 我们很乐意以最方便您项目的格式提供我们的化合物库。请在以下我们标准的微孔板中进行选择:Greiner Bio-One 781270、784201、781280、651201 或 Echo Qualified 001-12782 (LP-0200)、001-14555 (PP-0200)、001-6969 (LP-0400)、C52621,或者您可以提供您偏好的实验器具。如需化合物混合池,我们也可以根据要求提供。
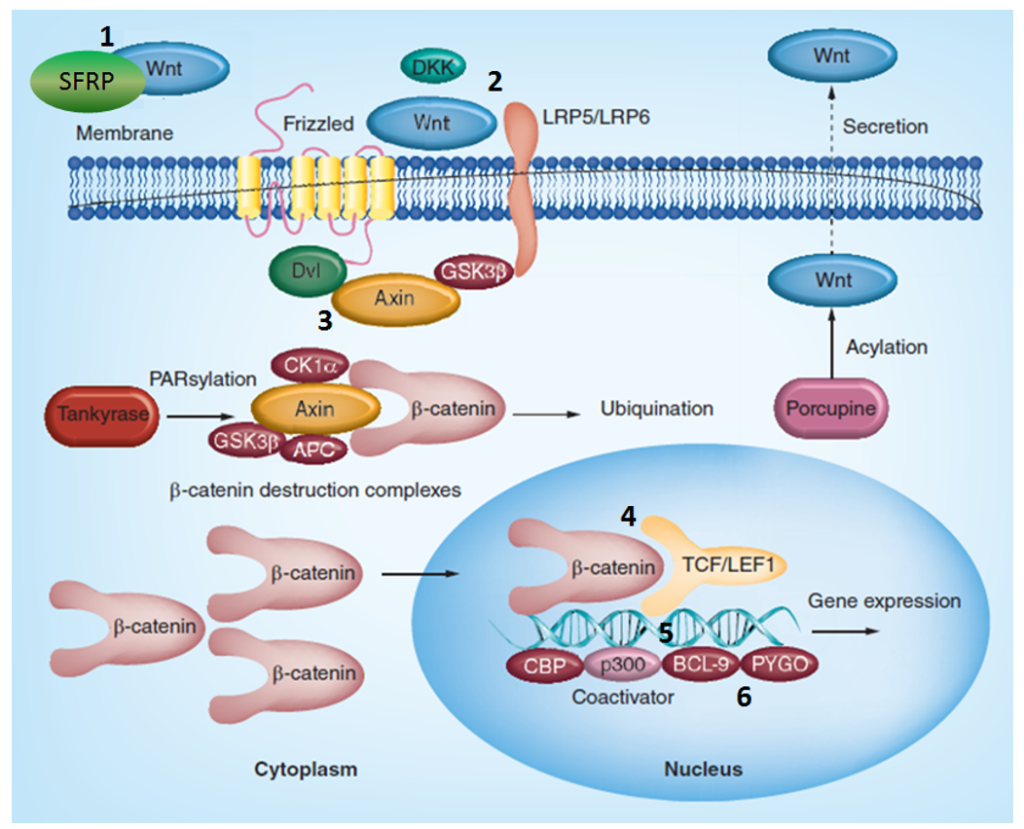
尽管许多出版物将 Wnt 抑制剂的鉴定和临床开发描述为潜在的抗肿瘤疗法19,20,但有限数量的报告涉及 Wnt 激活剂和/或增效剂的治疗效用21。这些小分子调节剂通常抑制与 β-catenin 稳定性有关的激酶,即 GSK3β 和 CK1。例如,CHIR-99021(CT99021)是一种 GSK-3α/β 抑制剂,IC50 为 10 nM/6.7 nM,对 GSK-3 的选择性是其最接近的同源酶 CDC2 和 ERK2 以及其他蛋白激酶的 500 倍以上。施用 CHIR-99021 显著增强了移植有小鼠或人类造血干细胞(HSC)的受体小鼠的造血再生22。这种方法通过影响支架蛋白 APC 和 Axin 诱导 Wnt 靶基因表达。然而,GSK3 参与细胞中的许多信号事件,并可能导致基于机制的毒性。PF-670462 是 CK1ε 的强效(IC50=7.7±2.2 nM)和选择性(相对于 42 种额外的激酶,>30倍)抑制剂,可磷酸化 Wnt 信号中的Dvl蛋白23。
目前需要具有新作用机制的 Wnt 信号传导抑制剂、激活剂和增强剂(即介导和/或增强内源性 Wnt 配体作用的试剂)。我们结合了我们的新化学和基于结构的方法,组装了一个约 10 000 种类先导化合物的库,能够解决 Wnt/Fz 信号传导的各个方面。代表 Wnt/Fz 级联的具体靶点包括 sFRP1、Dkk1、DyrK1A/B 以及 β-catenin 与 Tcf-4 和 Bcl-9 等几种转录因子的界面。有了这个库,我们可以使用基于靶标、基于报告物或表型的测定来测试这些化合物。预计已识别的命中是易处理的(即可行的 SAR 和潜在客户生成),适合作为开发治疗肿瘤、骨病、心血管(CV)/代谢、胃肠道(GI)和中枢神经系统/神经退行性疾病的药物的切入点。
用于库设计的 Fz/Wnt 信号级联的具体靶标和结点:
Wnt/sFRP-1 相互作用抑制剂。sFRP-1 蛋白家族包括结合 Wnt 配体和 Fz 受体的内源性分子。抑制 sFRP-1 可能导致 Wnt 信号传导的替代激活。此外,WAY 316606 是一种 sFRP-1 抑制剂(Ki=80 nM),在<1 nM 浓度的小鼠颅盖器官培养试验中,其被描述能够增加总骨面积24。据报道,它也是一种抗骨质疏松剂25。WAY-262611 是一种 Wnt 通路激动剂,在 TCF 萤光素酶测定中,其 EC50 为 0.63uM,可提高骨形成率。WAY-262611 在口服给药后,卵巢切除大鼠的骨小梁形成率表现出良好的药代动力学特性和剂量依赖性增加26。需要特别注意监测与 Wnt 通路长期紊乱相关的特定器官毒性,包括肿瘤27,28,尽管最近的数据表明情况并非如此29。这种选择由大约 1 200 种化合物表示。
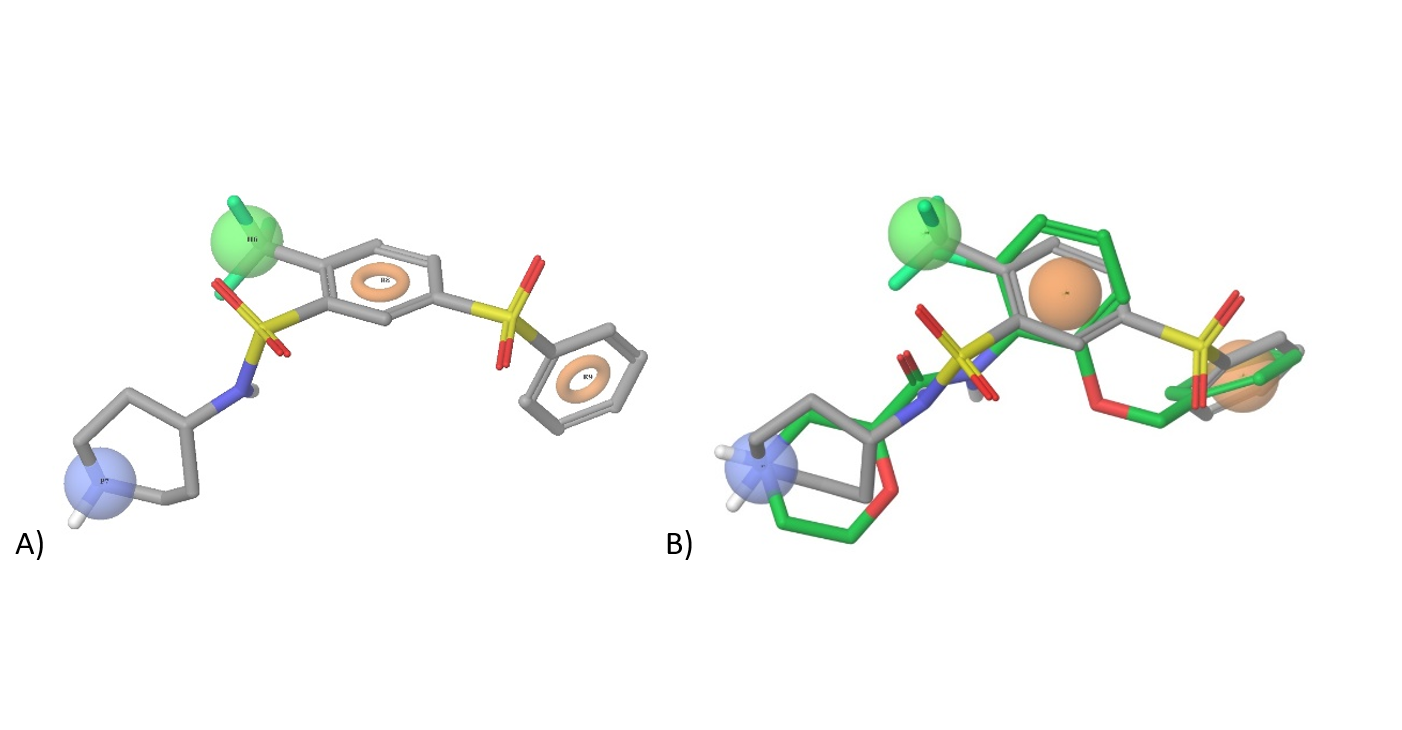
DKK-1 抑制剂。我们使用对接和基于配体的方法来寻找潜在的 DKK-1 结合剂。具体而言,利用 DKK1/LRP6 蛋白-蛋白相互作用(PPI)界面从整个 Enamine 筛选集合中选择匹配的配体。NCI8642 的类似物和其他报道的 DKK-1/LRP6 相互作用抑制剂用于基于配体的搜索和药效团建模。在对接计算中,我们重点研究了与 LRP6 结合的关键 DKK-1 环的拓扑和电荷分布特征。我们推断,阻断/破坏 DKK-1/LRP6 PPI 的这种环路特征可能会产生 Wnt 信号的调节剂和/或激活剂,同时保持“正常”的 Wnt-Fz-LRP6 信号。
我们在基于配体的方法中使用已知的 DKK-1 抑制剂 WAY 262611 及其 3D 药效团来识别 3k+ 类先导化合物作为潜在的结合剂。
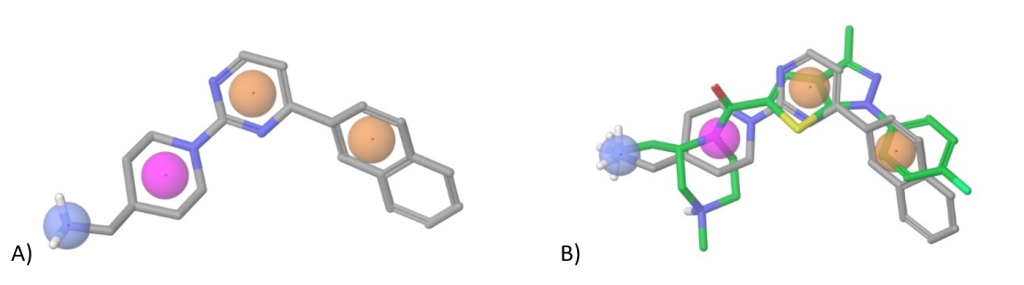
Dvl-Axin 抑制剂。Dvl-Axin 相互作用由特定的 PDZ 结构域介导。由于这个 PPI 界面的结构信息不可用,我们使用 AlphaFold2 和 PDZ 结构域的大量 SBio 数据建立了一个同源模型。由此产生的模型用于对整个筛选集合进行对接计算,并确定最有希望的“命中”化合物。结果,约 2 500 种最终 Dvl 偏向化合物被添加到库中。下面显示了推定 Dvl 结合剂的代表性示例。
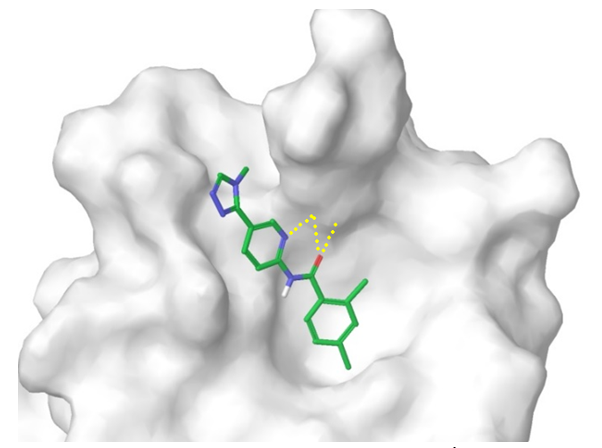
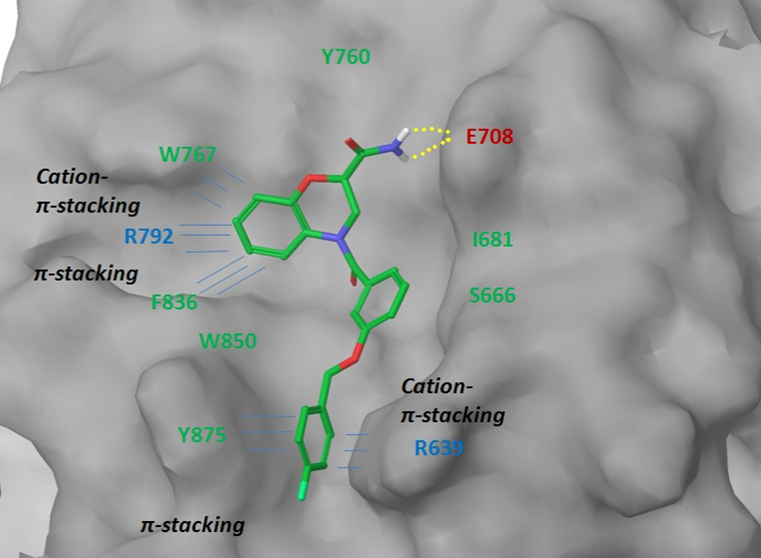
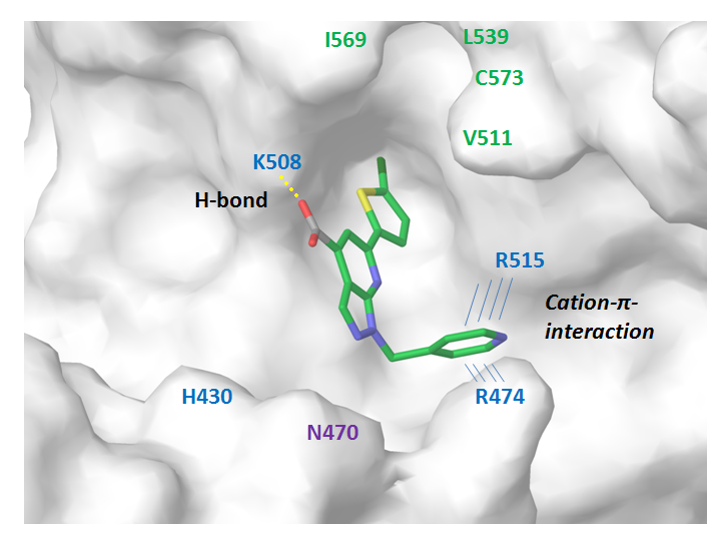
β-Catenin/TCF4 蛋白相互作用。为了模拟 β-catenin 和 TCF-4 之间的相互作用界面,我们使用了报告的结构数据(ACS Chem.Biol.2014193−201)来确定关键接触面,包括对接配体和 Arg474/515 之间质子化吡啶(阳离子)-π 相互作用。带有蛋白质 Lys508 残基的芳香族 NH2 基团的疏水口袋和氢键的拓扑结构允许构建相应的药效团模型(图 7)。在对接计算和评分截止后,将约 1800 个小分子集中组装成 β-Catenin/TCF4 亚库。
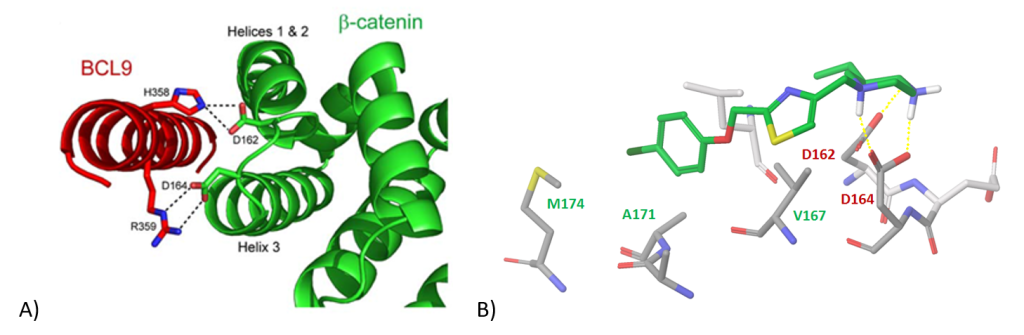
β-Catenin/Bcl9 蛋白相互作用界面。我们重点研究了两种生物分子之间螺旋-螺旋相互作用的现有结构数据。具体来说,我们研究了 H358、R359(Bcl9)和 D162、D164(β-catenin)之间的关键氢键(图 8)。在对接和结合位置优先之后,我们选择了与 D162/D164 氢键结合并与 β-catenin 表现出显著 π-堆叠/疏水相互作用区域的分子,从而得到 1 779 个化合物库。
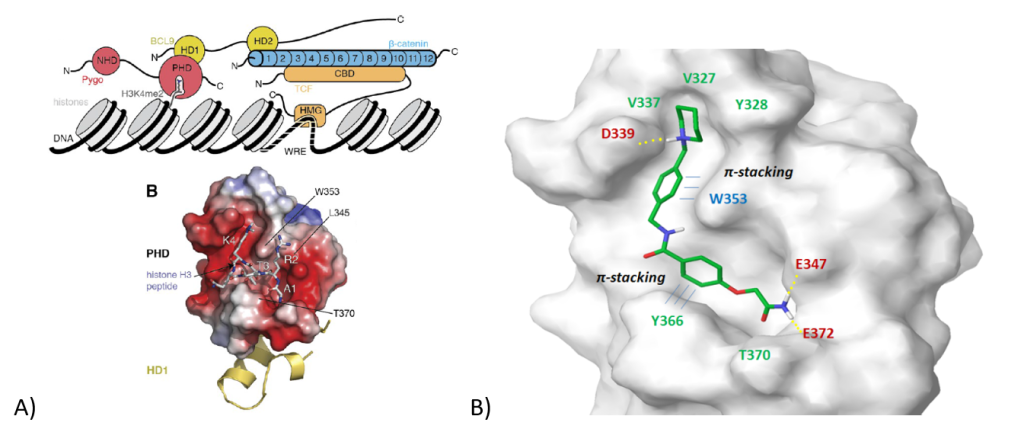
Bcl9/PYGO/组蛋白 3 相互作用界面。阻断 Wnt/Fz 信号传导的另一种选择是破坏 PYGO/组蛋白 3 的相互作用(图 9A)。值得注意的是,已经表明小分子可以与 PYGO 的 PHD 结构域结合,该结构域与甲基化组蛋白 3 残基结合,从而导致 β-catenin/Bcl9 相互作用的中断。在对接计算和评分优先级排序后,318 个小分子被选为该复合物的潜在 PPI 抑制剂。图 9B 显示了介导多重亲水相互作用的配体的代表性例子,即与 Phe366 和氢键的 p-堆叠作用。
参考文献
1. Interaction of Wnt and Activin in Dorsal Mesoderm Induction in Xenopus
Sokol, S. Y.; Melton, D. A. Dev. Biol.1992, 154, 348-355. doi:10.1016/0012-1606(92)90054-L
2. A role for maternal β-catenin in early mesoderm induction in Xenopus
Schohl, A.; Fagotto, F. EMBO J.2003, 22, 3303-3313. doi:10.1093/emboj/cdg303
3. Neural induction in Xenopus requires inhibition of Wnt/β-catenin signaling
Heeg-Truesdell, E.; LaBonne, C. Dev. Biol.2006, 298, 71-86. doi:10.1016/j.ydbio.2006.06.004
4. The Wnt/β-catenin pathway directs neuronal differentiation of cortical neural precursor cells
Hirabayashi, Y.; Itoh, Y.; Tabata, H.; Nakajima, K.; Akiyama, T.; Masuyama, N.; Gotoh, Y. Development2004, 131, 2791-2801. doi:10.1242/dev.01130
5. WNT Signaling molecules act in axis formation in the diploblastic metazoan Hydra
Hobmayer, B.; Rentzsch, F.; Kuhn, K.; Happel, C. M.; Cramer von Laue, C.; Snyder, P.; Rothbacher, U.; Holstein, T. W. Nature2000, 407, 186-189. doi:10.1038/35025063
6. Wnt/β-catenin signaling and body plan formation in mouse embryos
Marikawa, Y. Semin. Cell Dev. Biol.2006, 17, 175-184. doi:10.1016/j.semcdb.2006.02.009
7. Wnt signaling in disease and in development
Nusse, R. Cell Res.2005, 15, 28-32. doi:10.1038/sj.cr.7290260
8. A role for Wnt signaling in self-renewal of haematopoietic stem cells
Reya, T.; Duncan, A. W.; Ailles, L.; Domen, J.; Scherer, D. C.; Willert, K.; Hintz, L.; Nusse, R.; Weissman, I. L. Nature2003, 423, 409-414. doi:10.1038/nature01593
9. Wnt/β-catenin Is Essential for Intestinal Homeostasis and Maintenance of Intestinal Stem Cells
Fevr, T.; Robine, S.; Louvard, D.; Huelsken, J. Mol. Cell. Biol.2007, 27, 7551-7559. doi:10.1128/MCB.00104-07
10. Wnt signaling function in Alzheimer’s disease
De Ferrari, G. V.; Inestrosa, N. C. Brain Res. Rev.2000, 33, 1-12. doi:10.1016/S0165-0173(00)00018-3
11. Genetics meets epigenetics: HDACs and Wnt signaling in myelin development and regeneration
Li, H.; Richardson, W. D. Nat. Neurosci.2009, 12, 815-817. doi:10.1038/nn.2320
12. Wnt signaling in polycystic kidney disease
Benzing, T.; Simons, M.; Walz, G. J. Am. Soc. Nephrol.2007, 18, 1389-1398. doi:10.1681/ASN.2007020158
13. Islet Specific Wnt Activation in Human Type 2 Diabetes
Lee, S. H.; Demeterco, C.; Geron, I.; Abrahamsson, A.; Levine, F.; Itkin-Ansari, P. Exp. Diabetes Res.2008, 13. doi:10.1155/2008/728763
14. Wnt signaling in rheumatoid arthritis
Sen, M. Rheumatology2005, 44, 708-713. doi:10.1093/rheumatology/keh588
15. Wnt signaling in lung cancer
Mazieres, J.; He, B.; You, L.; Xu, Z.; Jablons, D. M. Cancer Lett.2005, 222, 1-10. doi:10.1016/j.canlet.2004.09.041
16. Wnt signaling in breast cancer: have we come full circle?
Brown, A. M. C. Breast Cancer Res.2001, 3, 351-355. doi:10.1186/bcr313
17. WNT1-induced secreted protein (WISP1), a novel regulator of bone turnover and Wnt signaling
Maeda, A.; et al. J. Biol. Chem.2015, 290, 14004-14018. doi:10.1074/jbc.M115.642306
18. Deficient Wnt signaling triggers striatal synaptic degeneration and impaired motor behavior in adult mice
Galli, S.; et al. Nat. Commun.2015, 5, 4992. doi:10.1038/ncomms5992
19. Directed cardiomyogenesis of human pluripotent stem cells by modulating Wnt/β-catenin and BMP signaling with small molecules
Aguilar, J. S.; et al. Biochem. J.2015, 469, 235-241. doi:10.1042/BJ20150274
20. Identification of 2-aminopyrimidine derivatives as inhibitors of canonical Wnt signaling pathway
Del Bello, F.; et al. Bioorg. Med. Chem.2015, 23, 5725-5733. doi:10.1016/j.bmc.2015.06.052
21. Wnt/β-catenin signaling and disease
Clevers, H.; Nusse, R. Cell2012, 149, 1192-1206. doi:10.1016/j.cell.2012.05.012
22. Regulation of Wnt signaling during adipogenesis
Bennett, C. N.; et al. J. Biol. Chem.2002, 277, 30998-1004. doi:10.1074/jbc.M204527200
23. Protein kinases CK1 and CK2 as new targets for neurodegenerative diseases
Perez, D. I.; Gil, C.; Martinez, A. Med. Res. Rev.2011, 31, 924-954. doi:10.1002/med.20202
24. A small molecule inhibitor of the Wnt antagonist secreted frizzled-related protein-1 stimulates bone formation
Bodine, P. V. N.; et al. Bone2009, 44, 1063-1068. doi:10.1016/j.bone.2009.02.011



